Momento dipolar de ligação
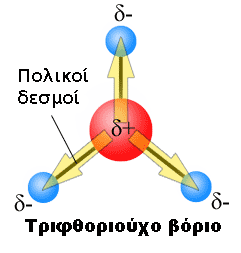
O momento dipolar de ligação ou momento de dipolo de ligação usa a ideia de momento do dipolo elétrico para medir a polaridade de uma ligação química dentro de uma molécula. Ele ocorre sempre que houver uma separação de cargas positivas e negativas. A ligação dipolo μ é dada por:
O dipolo de ligação é modelado como +δ — δ- com uma distância d entre as cargas parciais +δ e δ-. É um vetor, paralelo ao eixo de ligação, apontando do menos para o mais, como é convencional [1] para vetores momento de dipolo elétrico. (Alguns químicos desenham o vetor ao contrário, apontando de mais para menos, mas apenas em situações em que a direção não importa.)[1]
O vetor é extremamente importante para calcular o seno e cosseno dos ângulos na geometria sólida.