Profundidade de saturação dos carbonatos
Em oceanografia, profundidade de saturação dos carbonatos é a profundidade na qual o equilíbrio termodinâmico da reação de precipitação e dissolução de carbonato de cálcio (CaCO3) é atingido na coluna de água do oceano. Esse equilíbrio significa que a água do mar está saturada em termos de carbonato de cálcio naquela profundidade.[1]
Reação química
A reação química que descreve o equilíbrio termodinâmico do carbonato de cálcio em uma solução é a seguinte:[1]
Quando a reação é deslocada para a direita, os íons cálcio (Ca2+) e carbonato (CO32-) reagem para formar carbonato de cálcio (CaCO3), que é um sólido e precipita. Quando a reação é deslocada para a esquerda, o carbonato de cálcio se dissolve para formar os íons cálcio e carbonato. A reação química é controlada pelo seu produto de solubilidade (KPS).
Na reação de dissolução do carbonato de cálcio, o equilíbrio químico pode ser matematicamente expresso da seguinte maneira:[1]
onde [Ca2+], [CO32-] e [CaCO3] são as respectivas concentrações de íon cálcio, íon carbonato e carbonato de cálcio na solução.
Saturação na água do mar
A saturação do carbonato de cálcio (Ω) na água do mar pode ser expressa pela seguinte equação:[1]
Quando Ω (ômega) é igual a 1, a água do mar está saturada em termos de carbonato de cálcio. Valores de Ω inferiores a 1 indicam que a água do mar encontra-se subssaturada, enquanto valores superiores a 1 indicam que a água do mar está superssaturada.[1]
De uma maneira geral, o oceano superficial encontra-se superssaturado (Ω > 1) em termos de carbonato de cálcio.[1][2] Entretanto, esse estado de superssaturação diminui com o aumento da profundidade até atingir o valor unitário (Ω = 1). A profundidade na qual isso ocorre é conhecida como profundidade de saturação dos carbonatos. Abaixo dela, a saturação do carbonato de cálcio continua diminuindo e a água do mar torna-se subssaturada (Ω < 1). O estado de saturação do carbonato de cálcio diminui em direção ao oceano profundo devido às temperaturas mais baixas em relação à superfície e devido aos efeitos da pressão no oceano profundo.[1]
O conceito de saturação dos carbonatos é muito importante para os organismos marinhos (especialmente aqueles planctônicos) que utilizam carbonato de cálcio para secretar suas carapaças. Quando a água do mar está superssaturada, isso favorece o desenvolvimento desses organismos calcificantes.[1][3][4] Por outro lado, uma água do mar subssaturada é desfavorável para esses organismos. Assim, o estado de saturação da água pode ser um fator limitante para o crescimento desses organismos em caso de subssaturação.[1][3]
Aragonita e calcita
Existem duas formas minerais de carbonato de cálcio: aragonita e calcita. Na água do mar, a aragonita é mais solúvel que a calcita.[1] Consequentemente, a profundidade de saturação da aragonita no oceano global é menor do que a profundidade de saturação da calcita. Os fatores que mais influenciam a solubilidade do carbonato de cálcio na água do mar são temperatura, pressão e pH.[1][2] Temperaturas mais baixas aumentam a solubilidade tanto da aragonita quanto da calcita, assim como pressões mais elevadas. Massas de água ricas em dióxido de carbono apresentam pH com caráter mais ácido, facilitando a solubilidade do carbonato de cálcio. Por isso, massas de água frias, profundas e antigas apresentam maior solubilidade de aragonita e calcita.[1]
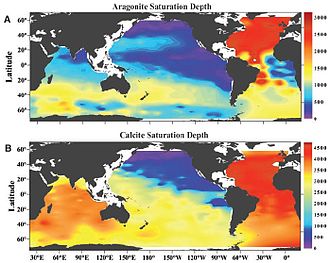
Distribuição geográfica da profundidade de saturação dos carbonatos
A profundidade de saturação dos carbonatos no oceano global não é igual em todos os lugares. Ela varia de acordo com a circulação termohalina no oceano profundo.[1][2][5] Regiões de subsidência de massas de água transportam águas superficiais pobres em dióxido de carbono para o oceano profundo. Isso faz com que a profundidade de saturação dos carbonatos nessas áreas seja grande. Por outro lado, algumas regiões onde há ressurgência transportam massas de água ricas em dióxido de carbono para a superfície, tornando menor a profundidade de saturação dos carbonatos. O Atlântico Norte é a região onde se encontram as maiores profundidades de saturação tanto de aragonita quanto de calcita.[1][5] Isso ocorre porque no entorno da Groenlândia estão as principais áreas de subsidência de massas de água do planeta, transportando águas superficiais pobres em dióxido de carbono para o oceano profundo. Em contrapartida, no Pacifico Norte encontram-se as menores profundidades de saturação de aragonita e calcita.[1][5] Nessa região há ressurgência das massas de água frias, profundas, antigas e ricas em dióxido de carbono. Devido à circulação termohalina no interior do oceano, a profundidade média de saturação dos carbonatos no Atlântico Norte é um pouco mais profunda do que no Atlântico Sul. Situação oposta é encontrada no Oceano Pacífico, onde a profundidade média de saturação dos carbonatos é um pouco mais profunda no sul em relação ao norte.
A profundidade média de saturação no Atlântico Norte está em torno de 4500 m para a calcita e cerca de 3000 m para a aragonita. Já no Pacífico Norte ela está em torno de 700 m para a calcita e cerca de 500 m para a aragonita.[1] A diferença observada entre os valores da profundidade de saturação da aragonita e da calcita é justificada pela maior solubilidade da aragonita em relação à calcita.
Diferença entre as profundidades de saturação e compensação dos carbonatos
A profundidade de saturação dos carbonatos não deve ser confundida com a profundidade de compensação dos carbonatos. A primeira está relacionada à termodinâmica da reação, enquanto a segunda está relacionada à cinética da mesma reação química.[1] A profundidade de saturação é uma propriedade da coluna de água e corresponde à profundidade na qual a saturação do carbonato de cálcio é igual a 100%. A profundidade de compensação dos carbonatos é uma propriedade do sedimento e corresponde à profundidade na qual os sedimentos no assoalho oceânico possuem teor de carbonato de cálcio inferior ou igual a 5%.[1] Ela também pode ser definida como a profundidade na qual não há carapaças de pterópodos depositadas na superfície do sedimento marinho.[6] Geralmente, a profundidade de compensação ocorre onde a saturação do carbonato de cálcio na coluna de água é inferior a 30% (isto é, Ω < 0,3).[1] Logo, a profundidade de compensação é sempre maior do que a profundidade de saturação dos carbonatos.[1][6]
A tabela abaixo apresenta as profundidades médias de saturação e de compensação de calcita e aragonita nos oceanos Atlântico e Pacifico.[1][6]
| Mineral | Atlântico | Pacifico |
| Profundidade de saturação | ||
| Calcita | 4300 m | 750 m |
| Aragonita | 1500 m | 500 m |
| Profundidade de compensação | ||
| Calcita | 5000 m | 3000 m |
| Aragonita | 2500 m | 1000 m |
Aquecimento global e acidificação oceânica

O aquecimento global é provocado por gases do efeito estufa. O mais importante desses gases é o dióxido de carbono, que também participa do sistema carbonato marinho. Abaixo estão as reações químicas envolvidas no sistema carbonato.[1]
Ficheiro:Impacts of ocean acidification (NOAA EVL).webm O aumento do dióxido de carbono (CO2) antropogênico na atmosfera e as interações oceano-atmosfera causam sua dissolução na água do mar. Essa dissolução tem o efeito de reduzir o pH da água devido à formação de íons H+ a partir dissociação do ácido carbônico (H2CO3).[1][3][5][7][8][9] Isso tem levado a um processo de acidificação da água do mar. O efeito tampão do sistema carbonato marinho tende a regular o pH do oceano para amenizar os efeitos da acidificação.[3][10] Para tanto, as últimas duas reações do sistema carbonato são deslocadas para a esquerda a fim de protonar o excesso de íons H+ na água, formando íons bicarbonato (HCO3-). Como conseqüência, esse deslocamento de reações diminui a saturação do carbonato de cálcio na água do mar devido à redução da disponibilidade dos ions carbonato. Nesse cenário, a coluna de água do oceano torna-se cada vez menos superssaturada em termos de carbonato de cálcio. Eventualmente, a diminuição da profundidade de saturação dos carbonatos poderá atingir a superfície do oceano.[3] Neste caso, organismos planctônicos (por exemplo, pterópodos) e bentônicos (por exemplo, corais escleractíneos) calcificantes sofrerão impactos negativos. Certas espécies poderão ser extintas devido à acidificação que vai causar corrosão em suas carapaças. A subssaturação de carbonato de cálcio na água do mar diminuirá a disponibilidade de carbonato para o desenvolvimento saudável dessas espécies.[3][4] Indiretamente, os predadores desses organismos também serão afetados causando um desequilíbrio na cadeia alimentar.[3] Os recifes de corais serão afetados, levando a perda de habitat para diversos organismos marinhos.[11]
Ver também
- Carbonato de cálcio
- Sistema carbonato
- Profundidade de compensação dos carbonatos
- Acidificação oceânica
Ligações externas
- Carbonate, [2] Dictionary.com. Retrieved 12 November 2017.
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 1,19 1,20 1,21 1,22 Predefinição:Citar livro
- ↑ 2,0 2,1 2,2 Predefinição:Citar livro
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Predefinição:Citar periódico
- ↑ 4,0 4,1 Predefinição:Citar periódico
- ↑ 5,0 5,1 5,2 5,3 Predefinição:Citar periódico
- ↑ 6,0 6,1 6,2 Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico