Redução de nitrilas
Em redução de nitrilas, uma nitrila é reduzida a uma amina ou a um aldeído na presença de um reagente químico adequado.[1][2]
Hidrogenação catalítica
A hidrogenação catalítica de nitrilas é, frequentemente, a rota mais econômica disponível para a produção de aminas primárias.[3] Os catalisadores usados na reação geralmente incluem metais do grupo 10, como níquel de Raney (à base de níquel),[4][5][6] negro de paládio ou dióxido de platina.[7] No entanto, outros catalisadores, como boreto de cobalto, também podem ser seletivos para a produção de aminas primárias:
Uma aplicação comercial dessa tecnologia é a produção de hexametilenodiamina a partir de adiponitrila, um precursor do Nylon 66.[8]
A depender das condições reacionais, as iminas intermediárias também podem sofrer ataques pelo hidrogênio, gerando aminas secundárias e terciárias:
Tais reações prosseguem via intermediários enamina.[9] A condição reacional mais importante para a produção seletiva de aminas primárias é a escolha do catalisador.[7] Outros fatores importantes incluem a escolha do solvente, o pH da solução, os efeitos estéricos e a temperatura e a pressão do hidrogênio.
Reduções estequiométricas
Agentes redutores para a conversão não-catalítica em aminas incluem hidreto de alumínio e lítio, boro-hidreto de lítio,[10] diborano[11] e sódio elementar em solventes alcoólicos.[12]
A aldeídos
Nitrilas também podem ser reduzidas a aldeídos. A síntese de aldeídos de Stephen usa cloreto de estanho (II) e ácido clorídrico para produzir um aldeído através da hidrólise de um sal de imínio resultante. Aldeídos também podem formar-se usando um doador de hidreto seguido da hidrólise in situ de uma imina. Reagentes úteis para essa reação são ácido fórmico com hidrogenação catalítica[13] ou hidretos metálicos que são usados para adicionar hidrogênio à nitrila. Por exemplo, boro-hidreto de sódio reduz nitrilas a solventes alcoólicos com um catalisador de CoCl2 ou com níquel Raney.[14] O agente redutor hidreto de di-isobutilalumínio, ou DIBAL-H, é outro hidreto de metal comumente utilizado. DIBAL-H atua como uma fonte de hidreto, adicionando um íon hidreto ao carbono da nitrila. A imina resultante é um intermediário relativamente estável que pode ser hidrolisado a aldeído.[15]
Mecanismo
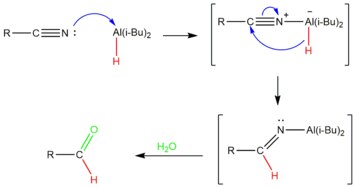
DIBAL-H é adicionado em quantidades controladas em baixas temperaturas para se realizar a redução parcial da nitrila.[16] O átomo de alumínio no DIBAL atua como um ácido de Lewis, aceitando um par de elétrons da nitrila. Esta é, então, reduzida pela transferência de um íon hidreto para o carbono da ligação tripla carbono-nitrila, produzindo-se uma imina. Após um processamento com água, o complexo de alumínio é hidrolisado para produzir o aldeído desejado.[17] Como o processamento hidrolítico gera o aldeído ao final, a nitrila não sofre redução excessiva.
Métodos eletroquímicos
Nitrilas aromáticas também podem ser reduzidas eletroquimicamente.[18][19]
Ver também
Referências
- ↑ Predefinição:Citar livro
- ↑ Predefinição:Citar livro
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ 7,0 7,1 Predefinição:Citar livro
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar livro
- ↑ Carey, F. A.; Sundberg, R. J.; Advanced Organic Chemistry, Part B: Reactions and Synthesis
- ↑ Predefinição:Citar livro
- ↑ Predefinição:Citar livro
- ↑ Predefinição:Citar periódico
- ↑ Predefinição:Citar livro